Zaltrap droga: erabiltzeko argibideak
Drogaren izen komertziala: Zaltrap
Jabea ez den Nazioarteko izena: Aflibercept
Dosierra: infusio disoluzio kontzentratua
Substantzia aktiboa: aflibercept
Talde farmakoterapeutikoa: antitumoral eragilea
Ezaugarri farmakologikoak:
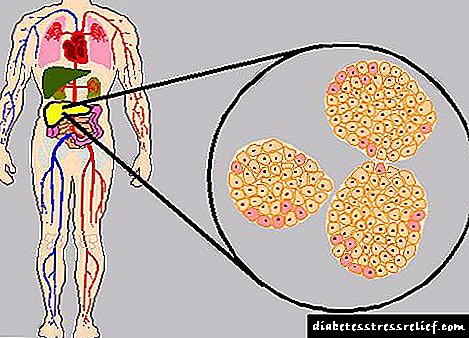
Antitumor droga. Aflibercept VEGF (hazkunde baskular endotelialaren faktorea) VEGF (hazkuntza baskular endotelialaren faktorea) osatutako proteina birkonbinatzaile bat da, FEG domeinura konektatutako FEG domeinura (zati kristalizagarriaren zati bat) G1 immunoglobulinaren zati bat (IgG1). Aflibercept DNA teknologia birkonbinanteen bidez sortzen da, hamsterreko obulutegiko zelula adierazpen sistema (CHO) K-1 erabiliz. Aflibercept-a 97 kDa-ko pisu molekularra duen glikoproteina kimikoa da. Proteinen glikosilazioek% 15 gehitzen dute pisu molekular guztiari, eta 115 kDa-ko pisu molekular osoa lortzen da. Hazkunde endotelialeko hazkunde faktorea A (VEGF-A), endotelial hazkunde baskular faktorea B (VEGF-B) eta plazenta hazkunde faktorea (P1GF) VEGF familiako faktore angiogenikoen faktore mitogeniko, kimiotactiko eta baskularraren iragazkortasun-eraginkortasun indartsuak izan daitezke. zelula endotelialetarako. VEGF-Ak hartzailearen bi tirozin kinasa bidez jarduten du - VEGFR-1 eta VEGFR-2, zelula endotelialen azalean kokatuta. P1GF eta VEGF-B VEGFR-1 hartzailearen tirozin kinasa soilik lotzen dira, zeinak endotelioen zelulen gainazalean presentziaz gain, leuzozitoen gainazalean kokatzen baitira. VEGF-A hartzaile hauen gehiegizko aktibazioak neovaskularizazio patologikoa eta iragazkortasun iragazkortasuna areagotzea ekar dezake. P1GF hanturazko zelulek neovaskularizazio patologikoarekin eta tumorearen infiltrazioarekin ere zerikusia dute. Aflibercept-ek VEGF-A-rekin lotzen duen "errezeptore-tranpa" disolbagarria da. Gainera, VEGF-A eta P1GF loturiko loturekin lotzen da. Aflibercept giza VEGF-A, VEGF-B eta P1GF taldeekin lotzen da jarduera biologikoa ez duten konplexu inerte egonkorrak eratuz. Ligandoen "tranpa" gisa jardutea, aflibercept-ek ligando endogenoak dagozkien hartzaileei lotzea eragozten du eta, beraz, errezeptore horien bidez seinaleen transmisioa blokeatzen du. Aflibercept-ek VEGF errezeptoreen aktibazioa eta zelula endotelialen ugaritzea blokeatzen ditu. Honela, tumoreak oxigeno eta mantenugaiak hornitzen dituzten ontzi berrien eraketa inhibitzen du. Aflibercept giza VEGF-A-rekin lotzen da (orekaren disoziazio konstantea (Cd) 0,5 pmol da VEGF-A165 eta 0,36 pmol VEGF-A121), giza P1GF (Cd 39 pmol P1GF-2), gizakiaren VEGF-B (Cd) 1,92 pmol) antzematen duen jarduera biologiko egonkorrik ez duen konplexu inerte egonkor baten eraketa.
Erabilerarako adierazpenak:
Minbizi kolorektalen minbizia (MKRP) (paziente helduen kasuan) kimioterapia duten oxaliplatinak erresistenteak diren edo erabili ondoren aurrera egiten duen minbizi metastatikoa (Zaltrap erregimen batekin konbinatuta irinotecan, fluorouracil, kaltzio folinatua (FOLFIRI)).
contraindications:
Afektibetasunarekiko edo drogearen excipientearekiko sentikortasuna Zaltrap, odoljario larria, hipertentsio arteriala, drogarekiko erresistentzia, III-IV klaseko bihotz gutxiegitasun kronikoa (NYHA sailkapena), gibeleko gutxiegitasuna larria (erabiltzeko datu falta), erabilera oftalmikoa edo sarrera barazki gorputza (droga Zaltrap drogaren propietate hipermosmotikoengatik), haurdunaldia, edoskitze aldia, haurrak eta nerabeak 18 urte (aplikazio esperientzia nahikoa eza dela) ast.Neurriak: giltzurrun-gutxiegitasun larria, hipertentsio arteriala, sistema kardiobaskularraren gaixotasun klinikoki esanguratsuak (CHD, bihotz-gutxiegitasun kronikoa I-II klasea NYHA sailkapenaren arabera), adin aurreratua, egoera orokorra ≥2 puntu gaixoaren ECOG egoera orokorra ebaluatzeko ( Ekialdeko Onkologoen Taldea).
Dosierra eta administrazioa:
Zaltrap 1 infusio moduan ematen da 1 orduz, eta ondoren FOLFIRI erregimen kimioterapeutikoa erabili behar da. Zaltrap-en dosi gomendatua FOLFIRI erregimen kimioterapeutikoarekin batera, 4 mg / kg-ko pisua da. Erregimen kimioterapeutikoa FOLFIRI: zikloaren lehenengo egunean - aldibereko iv infusioa, Y formako Irinotecan kateter bidez 180 mg / m2-ko dosian 90 min eta folin kaltzio (ezkerreko eta eskuineko racemates) 400 mg / m2-ko dosian 2 orduz. , ondoren, iv (bolus) fluorouracil administrazioa 400 mg / m2-ko dosian, eta jarraian fluorouracil barneko infusio jarraitua 2400 mg / m2-ko dosian 46 orduz. Kimioterapia zikloak 2 astean behin errepikatzen dira. Zaltrap-ekin tratamendua jarraitu behar da gaixotasunak aurrera egin arte edo onartezina den toxikotasuna garatu arte.
Bigarren mailako efektua:
Larritasun maila guztietan (% ≥20ko maiztasuna duten) erreakzio negatiboak (HP) maiz ikusitakoak, gutxienez% 2 ohikoagoak dira Zaltrap / FOLFIRI erregimen kimioterapeutikoa FOLFIRI erregimen kimioterapeutikoarekin baino (agerraldi-ordena murriztuz): leukopenia, beherakoa, neutropenia, proteinuria, ACT jarduera handitu, estomatitis, nekea, tronbozitopenia, ALT jarduera handitu, odol presioa areagotu, gorputzaren pisua gutxitu, jateko gogoa gutxitu, sudurretakoak, sabeleko mina, disfonia, kontzentrazio handiagoa. serum kreatinina eta buruko mina. Gehienetan 3-4 larritasuneko ondorengo HP-ak (% ≥5eko maiztasuna dutenak) ikusi ziren, gutxienez% 2 aldiz Zaltrap / FOLFIRI erregimen kimioterapeutikoarekin FOLFIRI erregimen kimioterapeutikoa baino (intzidentzia txikiagotzeko): neutropenia, beherakoa, hipertentsioa, leuzopenia, estomatitisa, nekea, proteinuria eta astenia. Orokorrean, gertakari kaltegarriak (larritasun maila guztietakoak) direla eta terapia eten zen, Zaltrap / FOLFIRI kimioterapiaren erregimena jaso zuten gaixoen% 26,8an FOLFIRI kimioterapiaren erregimena jaso zuten gaixoen% 12,1ekin alderatuta. Zaltrap / FOLFIRI kimioterapiaren erregimena jasotzen duten gaixoen% ≥1etan terapiaren arbuioa eragin duten HP arruntenak astenia / nekea, infekzioak, beherakoa, deshidratazioa, odol presioa handitzea, estomatitisak, venos tronboemboliko konplikazioak, neutropenia eta proteinuria izan ziren. Zaltrap sendagaiaren doikuntza (dosia murriztea eta / edo omisioak)% 16,7an egin zen. Zaltrap / FOLFIRI kimioterapia erregimena jasotzen duten gaixoen% 59,7an, 7 egun baino gehiagoko terapiaren ondorengo zikloen atzeratzea ikusi da FOLFIRI kimioterapiaren erregimena jasotzen zuten gaixoen% 42,6aren aurrean. Gaixotasunen aurrerapenaren ondorioz heriotza izan ezik, aztertutako erregimen kimioterapeutikoaren azken zikloaren ondorengo 30 egunen buruan ikusi da Zaltrap / FOLFIRI kimioterapiaren erregimena jaso duten gaixoen% 2,6an eta FOLFIRI kimioterapiaren erregimena jasotzen duten gaixoen% 1,0an. Zaltrap / FOLFIRI kimioterapiaren erregimena jasotzen duten gaixoen heriotzaren kausa infekzioa izan zen (sepsi neutropenikoa barne) 4 gaixoetan, deshidratazioa 2 gaixoetan, hipovolemia 1 paziente batean, entzefalopatia metabolikoa 1 gaixoan, arnas bideetako gaixotasuna (arnas akats akutua, 3 pazienteren aspirazio pneumonia eta biriketako tromboembolismoa, lesio gastrointestinala (ultzera duodenal baten odoljarioa, traktu gastrointestinalaren hantura, hesteetako obstrukzio osoa) 3 gaixoetan, ezezagunak ziren gaixoen ondorioz Iritsi 2 gaixoengan.Zaltrap / FOLFIRI kimioterapia erregimenarekin tratatutako gaixoetan (MedDRAren arabera) tratatutako gaixoen anormalitateak jarraian aurkezten dira. HP datuak nahigabeko erreakzio kliniko edo anormalitate gisa definitu dira laborategiko parametroetan; horien maiztasuna% ≥2 handiagoa zen (larritasun maila guztietako HParentzat) aflibercept taldean plazeboko taldearekin alderatuta, ICP duten pazienteetan egindako ikerketa batean. HP intentsitatea NCI CTC (National Cancer Institute Toxicity Rating Scale) 3.0 bertsioaren arabera sailkatu zen. HP maiztasuna zehaztea (OMEren sailkapenaren arabera): oso maiz (≥10%), maiz (% ≥1 - 3 graduko larritasuna), baldintza astenikoak (≥3 gradu larritasuna), gutxitan - zaurien narriadura (zauriaren ertzetan dibergentzia) , anastomosen porrota) (larritasun-maila guztiak eta ≥3 larritasun-maila).
Datu laborategiko eta instrumentalak: oso maiz - ACT jarduera, ALT (larritasun maila guztiak), gorputzaren pisua gutxitu (larritasun maila guztiak), askotan - ACT jarduera handitu, ALT ≥3 larritasun maila, gorputz pisua gutxitu ≥3 gradu larritasun maila.
Beste droga batzuekin interakzioa:
Zaltrapekin droga-elkarreraginei buruzko azterlan formalak ez dira egin. Konparaziozko ikerketetan, gainerako drogekin konbinatutako afibercept libre eta loturen kontzentrazioak monoterapiaren antzekoak ziren, eta horrek adierazten du konbinazio horiek (oxaliplatina, cisplatina, fluorouracil, irinotecan, docetaxel, pemetrexed, gemcitabine eta erlotinib) ez dutela eraginik farmakokinan aflibercept. Aflibercept-ek, bestalde, ez du eraginik izan irinotecan, fluorouracil, oxaliplatin, cisplatin, docetaxel, pemetrexed, gemcitabine eta erlotiniben farmakokinetikoetan.
Iraungitze data: 3 urte
Farmaziako opor baldintzak: preskripzio bidez
Contraindications
- Afibiseptibotasunarekiko edo sendagairen excipiente batzuetarako hipersentsibilitatea.
- hipertentsio arteriala, ez da zuzentzen mediku-zuzenketarako;
- bihotz gutxiegitasun kronikoa III-IV klasea (NYHA sailkapena),
gibeleko gutxiegitasuna (erabilerari buruzko datu falta)
- erabilera oftalmikoa edo administrazioa barazkiaren gorputzean (drogaren propietate hipermosmotikoak direla eta);
- edoskitze aldia,
- 18 urte baino gutxiago dituzten haurrak eta nerabeak (aplikazio esperientzia nahikorik ez dutelako).
giltzurrun-gutxiegitasun larria,
- sistema kardiobaskularraren gaixotasun klinikoki esanguratsuak (bihotzeko gaixotasun koronarioak, bihotz gutxiegitasun kronikoa I-II klasea NYHA sailkapenaren arabera);
- baldintza orokorra> eskala bateko 2 puntu, ECOG gaixoaren egoera orokorra ebaluatzeko (Ekialdeko Onkologoen Taldea).
Nola erabili: dosifikazioa eta tratamendua
Barrura, infusio gisa 1 orduz, eta ondoren FOLFIRI erregimen kimioterapeutikoa erabiltzea.
Gomendatutako dosia FOLFIRI erregimen kimioterapeutikoa konbinatuta 4 mg / kg gorputz pisua da.
Kimioterapia eskema FOLFIRI:
zikloaren lehenengo egunean - aldi bereko barneko infusioa Irinotecan Y formako kateter baten bidez 180 mg / m2-ko dosian 90 minutuz eta kaltinazko folinatua (ezkerreko eta eskuineko racemates) 400 mg / m2-ko dosian 2 orduz, eta jarraian intravenous (bolus) ) fluorouracilaren sarrera 400 mg / m2-ko dosian, eta jarraian fluorouracil barneko perfusio jarraitua 2400 mg / m2-ko dosian 46 orduz.
Kimioterapia zikloak 2 astean behin errepikatzen dira.
Tratamendua jarraitu behar da gaixotasunaren aurrerapena edo onartezina den toxikotasuna garatu arte.
Dosifikazio-erregimena / tratamendua atzeratzeko gomendioak
Tratamendua eten egin behar da:
- hemorragia larriaren garapenarekin
- tratamendu gastrointestinalaren hormen zulaketaren garapenarekin,
- fistula eratzearekin
- krisi hipertentsiboa edo entzefalopatia hipertentsiboa,
- arterial tromboemboliko konplikazioak garatzearekin;
- sindrome nefrotikoa edo mikroangiopatia tronbotikoa garatzearekin;
- hipersentsibilitate erreakzio larriak garatzea (bronkospasmoa, arnasaren gabezia, angioedema, anafilaxia);
- esku-hartze medikoa behar duten zauriak sendatzea;
- posterior encefalopatia sindromea itzulgarriarekin (POP), ondorengo leukoencefalopatia itzulgarria (POP) izenarekin ere ezaguna.
Aurreikusitako ebakuntza baino gutxienez 4 aste lehenago, Zaltrap-ekin tratamendua eten egin behar da aldi baterako.
Kimioterapia atzeratua Zaltrap / FOLFIRI
Neutropenia edo tronbozitopenia: Zaltrap / FOLFIRI erregimen kimioterapeutikoa erabiltzea atzeratu egin behar da odol periferikoko neutrofilo kopurua> 1500 / µl eta / edo odol periferikoko plaketen kopurua> 75000 / µl arte handitu arte.
Hipersentsibilitate erreakzio arinak edo moderatuak (larruazala hustuz, rash, urtikaria eta pruritoa barne): Tratamendua eten egin behar da erreakzioa gelditu arte. Beharrezkoa bada, hipersentsibilitate erreakzioa geldiarazteko, posible da GCS eta / edo antihistaminak erabiltzea.
Ondorengo zikloetan, GCS eta / edo antihistaminak premedikatzea aintzat har dezakezu.
Hipersentsibilitate erreakzio gogorrak (bronkospasmoa, disnea, angioedema eta anafilaxia barne): Zaltrap / FOLFIRI kimioterapiaren erregimena eten behar da eta hipersentsibilitate erreakzioa etetea helburu duen terapia eten behar da.
Zaltrap-en tratamenduaren geroratzea eta dosia egokitzea
Presio arterialaren igoera: behin-behineko eten egin behar duzu botikaren erabilera odol-presioaren gehikuntzaren gaineko kontrola lortu arte.
Odol presioaren gehikuntza nabarmen errepikatzen den neurrian, droga erabiltzea eten egin behar da hipertentsioaren gehikuntzaren gaineko kontrola lortu arte eta ondorengo zikloetan bere dosia 2 mg / kg gorputz pisura murriztea lortu arte.
Proteinuria: Drogaren erabilera eten egin behar da proteinuria> 2 g / eguneko. Tratamendua berriro hastea posible da proteinuria 2 g / egunean murriztu ondoren; Zaltrap erabiltzea gelditu egin behar da proteinuria% 20 murriztu arte), gutxienez% 2 gehiago erabiltzen da kaltoterapia-erregimena erabiltzen denean Zaltrap / FOLFIRI FOLFIRI erregimen kimioterapeutikoarekin baino (agerraldi orden txikiagoa): leukopenia, beherakoa, neutropenia, proteinuria, ACT jarduera handitu, estomatitis, nekea, trombocitopenia, jarduera handitu ALT, odol-presioa handitu, pisua galtzea, jaitsi gosea, epistaxis, sabeleko mina, dysphonia, kreatinina serum kontzentrazio eta buruko mina handitu.
3-4 larritasuna duten ondorengo HPak gehienetan ikusi ziren (maiztasuna>% 5), gutxienez% 2 gehiago Zaltrap / FOLFIRI erregimen kimioterapeutikoa aplikatzean FOLFIRI erregimen kimioterapeutikoa erabiltzen zenean (intzidentzia tasa murrizteko): neutropenia, beherakoa, hipertentsioa, leuzopenia, estomatitisa, nekea, proteinuria eta astenia.
Orokorrean, gertakari kaltegarriak (larritasun maila guztietakoak) direla eta terapia eten zen, Zaltrap / FOLFIRI kimioterapiaren erregimena jaso zuten gaixoen% 26,8an FOLFIRI kimioterapiaren erregimena jaso zuten gaixoen% 12,1ekin alderatuta.
Zaltrap / FOLFIRI kimioterapiaren erregimena jasotzen duten gaixoen% 1ean terapia uztea eragin duten HP arruntenak astenia / nekea, infekzioak, beherakoa, deshidratazioa, odol presioa handitzea, estomatitisak, konplikazio venos tromboembolikoak, neutropenia eta proteinuria izan ziren.
Dosiaren doikuntza (dosi murrizketa eta / edo omisioak)% 16,7an egin zen. Zaltrap / FOLFIRI kimioterapia erregimena jasotzen duten gaixoen% 59,7an, 7 egun baino gehiagoko terapiaren ondorengo zikloen atzeratzea ikusi da FOLFIRI kimioterapiaren erregimena jasotzen zuten gaixoen% 42,6aren aurrean.
Gaixotasunen aurrerapenaren ondorioz heriotza izan ezik, aztertutako erregimen kimioterapeutikoaren azken zikloaren ondorengo 30 egunen buruan ikusi da Zaltrap / FOLFIRI kimioterapiaren erregimena jaso duten gaixoen% 2,6an eta FOLFIRI kimioterapiaren erregimena jasotzen duten gaixoen% 1,0an. Zaltrap / FOLFIRI kimioterapiaren erregimena jasotzen duten gaixoen heriotzaren kausa infekzioa izan zen (sepsi neutropenikoa barne) 4 gaixoetan, deshidratazioa 2 gaixoetan, hipovolemia 1 paziente batean, entzefalopatia metabolikoa 1 gaixoan, arnas bideetako gaixotasuna (arnas akats akutua, aspirazio pneumonia) eta biriketako embolismoa) 3 pazienteetan, lesio gastrointestinala (ultzera duodenal baten odoljarioa, traktu gastrointestinalaren hantura, hesteetako oztopo osoa) 3 gaixoetan, emaitza ezezagunak Arrazoi nabariak 2 gaixoetan.
Zaltrap / FOLFIRI kimioterapia erregimenarekin tratatutako gaixoetan (MedDRAren arabera) tratatutako gaixoen anormalitateak jarraian aurkezten dira. HP datuak nahigabeko erreakzio kliniko edo anormalitate gisa definitu dira laborategiko parametroetan, maiztasuna>% 2 handiagoa izan baitzen (larritasun maila guztietako HParentzat) aflibercept taldean plazeboko taldearekin alderatuta, ICP duten pazienteetan egindako ikerketa batean. HP intentsitatea NCI CTC (National Cancer Institute Toxicity Rating Scale) 3.0 bertsioaren arabera sailkatu zen.
HP maiztasuna zehaztea (OMEren sailkapenaren arabera): oso maiz (>% 10), maiz (>% 1 -% 0,1 -% 0,01 - 3 graduko larritasuna).
Odol eta sistema linfatikotik: oso maiz - leukopenia (larritasun maila eta> 3 gradu larritasun guztiak), neutropenia (larritasun maila guztiak eta> 3 gradu larritasun), tronbozitopenia (larritasun maila guztiak), maiz - larritasun maila guztietako neutropenia febril eta> 3 larritasun gradu, tronbozitopenia> 3 larritasun gradu.
Sistema immunologikoaren aldetik: maiz - hipersentsibilitate erreakzioak (larritasun maila guztiak), gutxitan - hipersentsibilitate erreakzioak> larritasun maila 3.
Metabolismoaren eta elikaduraren aldetik: oso maiz - gosea gutxitzea (larritasun-maila guztiak), askotan - deshidratazioa (larritasun-maila guztiak eta> 3 gradu-larritasun-maila), jateko gogoa galtzea> larritasun-maila 3.
Nerbio-sistemaren albo batetik: oso maiz - buruko mina (larritasun-maila guztietakoak), maiz - buruko mina> 3 graduko larritasuna, gutxitan - atzealdeko entzefalopatia sindromea itzulgarria (SEDF).
Sistema kardiobaskularretik: oso maiz - odol presioa handitu da (larritasun maila guztietakoak) (odol presioaren gehikuntza izan duten pazienteen% 54an> 3 graduko larritasuna, lehen bi tratamendu zikloetan garatutako odol presioa handitzea), hemorragia / hemorragia (gradu guztiak) larritasuna), hemorragia mota ohikoena sudurreko erredura txikiak (1-2 gradu larritasun), maiz arterial konplikazio tromboembolikoak (ATEO) (adibidez, zerebrovaskularreko nahaste akutuak, zerebrovaskularreko eraso iskemikoak barne; angina pektoriala, tronbo birikardiakoa, miokardioko infartua, tromboembolismo arteriala eta kolitis iskemikoa) (larritasun maila guztiak), konplikazio tromboemboliko venosoak (VTEO) (zain bizkarreko tronboia eta biriketako embolia) larritasun maila guztiak, odoljarioak> 3 urteko larritasuna, 3 urteko larritasuna. odoljario gastrointestinala, hematuria, prozedura medikoen ondorengo odoljarioa, maiztasun ezezaguna - Zaltrap jasotzen duten pazienteetan, intrakraniako hemorragia larria eta biriketako hemorragiaren garapena ny / hemoptisi, emaitza negatiboarekin batera.
Arnas sistematik: oso maiz - arnasaren gabezia (larritasun maila guztietakoak), sudur-hazteak (larritasun-maila guztietakoak), disfonia (larritasun-maila guztietakoak), maiz - orofaringeetako mina (larritasun-maila guztiak), rinorrea (1-2 rinhinhea bakarrik ikusi zen) larritasuna), gutxitan - arnasa gutxitasuna> 3 gradu larritasun, sudur hazteak> larritasun 3 gradu, disfonia> larritasun 3 gradu, orofaringeko mina> larritasun 3 gradu.
Digestio-sistematik: oso maiz - beherakoa (larritasun-maila guztiak eta> 3 gradutasun-maila), estomatitisak (larritasun-maila guztiak eta> 3 gradu-maila), sabeleko mina (larritasun-maila guztiak), goiko sabelean mina (larritasun-maila guztiak) , askotan - sabeleko minak> 3 gradu larritasun, goiko sabeleko mina> larritasun 3 gradu, hemorroideak (larritasun maila guztiak), rectumetik odoljarioak (larritasun maila guztiak), rectumean mina (larritasun maila guztiak), haginetako mina ( larritasun maila guztiak), estomatitis aftosa (larritasun maila guztiak) jan), fistulen eraketa (anal, heste-gernu txikia, kanpoko heste txikia, azal txikia, kolon-baginala, heste barnekoa) (larritasun-maila guztiak), gutxitan - fistulak gastrointestinala eratzea> larritasun-maila 3, maila guztietako traktu gastrointestinalaren hormen perforazioa. 3 larritasun-maila, traktu gastrointestinalaren hormen zulaketa barne, rectumetik odoljarioa> larritasun 3 gradu, estomatitis aftosa> larritasun 3 gradu, mina rectumean> 3 gradu larritasun.
Larruazaletik eta larruazalpeko ehunetatik: oso maiz - palmondo-landare eritrodisestesia sindromea (larritasun maila guztiak), maiz - larruazaleko hiperpigmentazioa (larritasun maila guztiak), palmondo-plantar eritrodisestesia sindromea> 3 gradu larritasun.
Gernu sistematik: oso maiz - proteinuria (konbinatuen eta laborategiko datuen arabera) (larritasun maila guztiak), serum kreatininaren kontzentrazioaren gehikuntza (larritasun maila guztiak), maiz - proteinuria> larritasun maila 3, gutxitan - sindrome nefrotikoa. Proteinuria eta hipertentsio arteriala zuten gaixo batek Zaltrap / FOLFIRI kimioterapia erregimenarekin tratamendua jaso zuten 611 gaixoetatik mikrogigiopatia tronbotikoa diagnostikatu zioten.
Erreakzio orokorrak: oso maiz - baldintza astenikoak (larritasun maila guztiak), nekearen sentsazioa (larritasun maila guztiak eta> 3 gradu larritasun maila), maiz - baldintza astenikoak (> 3 gradu larritasun maila), gutxitan - zauriak sendatzea (zauriaren ertzetan dibergentzia, anastomosaren porrota). ) (larritasun maila guztiak eta> 3 gradu larritasun).
Datu laborategiko eta instrumentalak: oso maiz - ACT jarduera, ALT (larritasun gradu guztiak), gorputzaren pisua gutxitu (larritasun maila guztiak), askotan - ACT jarduera handitu, ALT> 3 gradu larritasun, pisu galera> 3 gradu larritasun.
Gaixoen talde berezietan kontrako erreakzioen maiztasuna
Adineko gaixoetan (> 65 urte), beherakoa, zorabioak, astenia, pisu galera eta deshidratazioen intzidentzia adin txikiagoko pazienteetan baino% 5 handiagoa zen. Adineko gaixoek estuki kontrolatu behar dute beherakoa eta / edo deshidratazio posibleak garatzeko.
Droga hasi zen unean giltzurrunetako narriadura arina zuten pazienteetan, HP hasi zen garaian giltzurruneko funtzio narriadurarik ez zuten pazienteen parekoa zen. Giltzurrun-narriadura moderatua eta larria duten pazienteetan, giltzurruna ez den HP-ren agerraldia giltzurruneko porrotik izan ez duten gaixoen parekoa izan zen, deshidratazio maiztasuna (larritasun maila guztietako bat)% 10ean izan ezik.
Gainerako proteina drogak bezala, aflibercept immunogenoak izateko arrisku potentzial bat du. Oro har, saiakuntza kliniko onkologiko guztien emaitzen arabera, gaixoetako inork ez zuen aflibercept antigorputzetarako titulu handia erakutsi.
2 astean behin 7 mg / kg gainditzen duten dosietan Zaltrap hartzeko segurtasunari buruzko daturik ez dago, edo 9 mg / kg behin 3 astean behin. Dosi-erregimen hauekin ikusitako HP ohikoenak drogaren erabilerarekin dosi terapeutikoetan antzeman ziren HPren antzekoak ziren.
Ez dago drogarako antidoto zehatzik.Gaindosi bat izanez gero, pazienteek laguntza tratamendua behar dute, bereziki hipertentsio arterialaren eta proteinuriaren jarraipena eta tratamendua. Gaixoak estu kontrolatu behar du HP edozein identifikatu eta kontrolatzeko.
Argibide bereziak
Tratamendua hasi aurretik eta aflibercept-ekin tratamendu ziklo berri bakoitza hasi aurretik, gomendagarria da odol azterketa orokor bat egitea leukozitoaren formularen definizioarekin.
Neutropenia> 3 gradu larritasunarekin batera, G-CSFren erabilera terapeutikoa kontuan hartu beharko litzateke. Gainera, konplikazio neutropenikoak garatzeko arrisku handiagoa duten pazienteetan, neutropenia prebenitzeko G-CSF sartzea gomendatzen da.
Gaixoak etengabe kontrolatu behar dira odoljarioa eta beste hemorragia larrien seinaleak eta sintomak aurkitzeko. Aflibercept ez da hemorragia larria duten pazienteei eman behar.
Gaixoak kontrolatu behar dira traktu gastrointestinalaren hormen zulaketa seinaleak eta sintomak aurkitzeko. Hesietako hesteetako hormen zulaketaren kasuan, afliberceptarekin tratamendua eten behar da.
Fistulak garatuz gero, afliberceptarekin tratamendua eten behar da.
Aflibercept tratamenduarekin batera, odol presioa kontrolatzea gomendatzen da 2 astean behin, baita aflibercept administrazioa hartu aurretik presio arteriala kontrolatzea ere, edo maizago aflibercept tratamenduarekin batera zantzu klinikoen arabera. Aflibercept tratamenduan zehar odol presioa areagotzen bada, terapia antihipertentsiboa egokia erabili behar da eta odol presioa aldizka kontrolatu. Odol presioaren gehiegizko gehikuntzarekin, aflibercept-ekin tratamendua eten egin behar da odol-presioa xede-balioetara jaitsi arte, eta ondorengo zikloetan aflibercept dosia 2 mg / kg-ra murriztu behar da. Krisi hipertentsiboa edo entzefalopatia hipertentsiboa garatzeko kasuan, drogetako aflibercept administrazioa eten beharko litzateke.
Kontuz ibili behar da Zaltrap patologia kardiobaskularra klinikoki duten pazienteei administratzean, hala nola bihotzeko gaixotasun koronarioak eta bihotz gutxiegitasuna. Ez dago drogak administratzeko entsegu klinikoak III eta IV klase funtzionalen bihotz gutxiegitasuna duten pazienteei NYHA sailkapenaren arabera.
Gaixoak ATEO garatzen badu, afliberceptarekin tratamendua eten behar da.
Aflibercept administrazio bakoitzaren aurretik, proteinuria zehaztu beharko litzateke adierazle-proba erabiliz edo gernuan proteina / kreatininaren erlazioa zehaztu proteinaren garapena edo handitzea. Gernuan proteina / kreatinina proportzioa duten 1 pazienteek proteina kopurua gernuan zehaztu beharko lukete.
Sindrome nefrotikoa edo mikroangiopatia tronboziala garatuz gero, afliberceptarekin tratamendua eten beharko litzateke.
Hipersentsibilitate erreakzio larria gertatuz gero (bronkospasmoa, arnasaren gutxitasuna, angioedema eta anafilaxia), tratamendua eten behar da eta erreakzio horiek gelditzeko bideratutako terapia egokia hasi behar da.
Afliberceptarekiko hipersentsibilitate erreakzio arina sortzen bada (larruazaleko hiperemia, rash, urtikaria, pruritoa), tratamendua eten egin beharko da erreakzioa ebatzi arte. Klinikoki beharrezkoa bada, erreakzio horiek geldiarazteko kortikoideak eta / edo antihistaminak erabil daitezke. Ondorengo zikloetan, GCS eta / edo antihistaminak premedikatzea aintzat har dezakezu. Aurretik hipersentsibilitate erreakzioak izan dituzten gaixoen tratamendua berriro hastean, kontuz ibili behar da, izan ere Zenbait gaixoetan, hipersentsibilitate erreakzioen garatzea berriro ikusi zen, profilaxia izan arren, kortikoideen erabilera barne.
Afibiseptiboaren erabilera eten egin behar da gutxienez 4 astez interbentzio kirurgiko handien ondoren eta zauri kirurgikoa erabat sendatu arte. Interbentzio kirurgiko txikiak egiteko, esaterako, katetero venoso zentrala instalatzea, biopsia, hortzak ateratzea, afliberceptarekin tratamendua has daiteke / berriro hasi daiteke zauri kirurgikoa erabat sendatu ondoren.Mediku esku-hartzea behar duten zauriak sendatzeko gaixoen kasuan, aflibercept erabiltzea eten egin behar da.
POPak egoera mentalaren aldaketa, epilepsia-desamortizazioak, goragalea, gorabeherak, buruko mina eta ikusmen nahasteak aldatzen dira. LUTSen diagnostikoa garuneko RMN eskaneo bidez baieztatzen da. POP duten pazienteetan afiberbiseptiboen erabilera eten egin behar da.
Gaixo zaharrek (> 65 urte) beherakoa, zorabioak, astenia, pisua galtzea eta deshidratazioa sortzeko arrisku handiagoa dute. Arriskua gutxitzeko, gaixoek gainbegiratze medikoa behar dute beherakoa eta deshidratazioaren seinaleak eta sintomak antzemateko eta tratatzeko.
Egoera orokorreko indizea> 2 puntu duten gaixoek (Ekogo Ekologikoko Taldeko Elkartearen ECOGren bost puntuko 0-4 puntuko ebaluazio eskalan) edo gaixotasun konkomitente larriak dituztenek emaitza kliniko kaltegarriak izateko arrisku handiagoa izan dezakete, eta gainbegiratze klinikoa goiz detektatzeko zaintza medikoa behar dute.
Zaltrap soluzio hipermosmotikoa da, konposizioa espazio intraokularra sartzearekin bateraezina dena. Droga ezin da barazki gorputzean sartu.
Ez da azterlanik egin Zaltrap-ek ibilgailuak gidatzeko duen gaitasunean edo potentzialki arriskutsuak diren bestelako jardueretan. Gaixoek ikusmenean eta kontzentratzeko gaitasunean eragiten duten sintomak sortzen badituzte, baita erreakzio psikomotorrak moteltzen badituzte ere, gaixoei gomendatu behar zaie ibilgailuak gidatzea eta arriskuan egon daitezkeen bestelako jarduerak saihestea.
Haurdunaldia eta edoskitzea
Ez dago daturik haurdun dauden emakumeetan aflibercept erabileraren inguruko datuei buruz. Ikerketa esperimentaletan, aflibercept-en animalien efektu enbriootoxikoak eta teratogenikoak agerian geratu ziren. delako angiogenesiak garrantzi handia du enbrioia garatzeko. Zaltrapekin batera angiogenesiaren inhibizioak haurdunaldiaren garapenerako kaltegarriak ez diren efektuak eragin ditzake. Haurdunaldian droga erabiltzea kontraindikatuta dago.
Haurtzaroko adingabeei Zaltrap tratamenduan kontzepzioa ekiditeko gomendatu behar zaie. Fetuaren gainean kalteak eragin ditzakeen eraginen berri eman behar zaie.
Haur adingabeak eta gizon emankorrak diren emakumeek antisorgailu metodo eraginkorrak erabili beharko dituzte tratamenduan eta gutxienez 6 hilabetetan botikaren azken dosia egin ondoren.
Badira ugalkortasuna gutxitzeko arriskua aflicceptarekin tratatzen duten bitartean (tximinoei buruz egindako ikerketetan lortutako datuetan oinarrituta, aflibercept-ek emankortasun nahasteak eragin zituen gizonezkoetan eta emakumezkoetan, erabat itzulgarriak 8-18 aste ondoren).
Ez da azterlan klinikorik egin Zaltrap-ek bularreko esnea ekoiztean, afiberceptak bularreko esnearekin isolatzea eta drogak haurtxoetan duen eragina ebaluatzeko.
Ez da ezagutzen bularreko esnearekin afibercept duten emakumetan kanporatzen den ala ez. Hala ere, ezin da baztertu afibercept sartzea bularreko esnetan sartzea, baita haurtzaroan afliberceptek sor ditzakeen kontrako erreakzio larriak garatzeko aukera ere, beharrezkoa da edoskitzea ez uko egitea edo Zaltrap ez erabiltzea ( drogak amaren erabileraren garrantziaren arabera).
Elkarrekintza
Zaltrapekin droga-elkarreraginei buruzko azterlan formalak ez dira egin.
Konparaziozko ikerketetan, aflibercept aske eta lotu gabeko kontzentrazioak kontzeptuak antzekoak ziren aflibercept-en monoterapiarekin, eta horrek adierazten du konbinazio horiek (oxaliplatina, cisplatina, fluorouracil, irinotecan, docetaxel, pemetrexed, gemcitabine eta erlotinib) ez dutela eraginik. aflibercept-aren farmakokinetika.
Sailkapen Nosologikoa (ICD-10)
| Infusiorako irtenbide kontzentratua | 1 ml |
| substantzia aktiboa: | |
| aflibercept | 25 mg |
| excipients: sodio dihidrogeno fosfato monohidratoa - 0,5774 mg, sodio hidrogeno fosfato heptahidrato - 0,2188 mg, azido zitrikoa monohidrato - 0,0443 mg, sodio zitrato dihidratatu - 1,4088 mg, sodio kloruroa - 5,84 mg, 0,1 M soluzio klorhidriko. azido edo 0,1 M sodio hidroxido disoluzio - pH 5,9-6,5 arte, sakarosa - 200 mg, polisorbato 20 - 1 mg, injekzio ura - 1 ml arte |
Farmacodinamia
Aflibercept elkartzeko proteina birkonbinatzaile bat da VEGF (hazkunde endotelial baskularrahazkunde faktore endotelialeak) errezeptorearen kanpoko domeinu zatiak VEGF-1 eta VEGF-2 Fc domeinura konektatuta (kristalizatzeko gai den zatia) IgG1 Pertsona.
Aflibercept DNA teknologia birkonbinanteen bidez sortzen da, hamsterreko obulutegiko zelula adierazpen sistema (CHO) K-1 erabiliz.
Aflibercept-a 97 kDa-ko pisu molekularra duen glikoproteina kimikoa da. Proteinen glikosilazioek% 15 gehitzen dute pisu molekular guztiari, eta 115 kDa-ko pisu molekular osoa lortzen da.
Hazkunde endoteliala hazkunde baskularra A (VEGF-A), B endotelial hazkunde baskular faktorea (VEGF-B) eta plazentaren hazkuntza faktorea (PlGF) erlazionatu VEGF- Zelula endotelialen iragazkortasun mitogeniko, kimiotactiko eta baskularraren faktore indartsu gisa funtziona dezaketen faktore angiogenikoen familia. efektu VEGF-A bi tirozin kinasa hartzailearen bidez - VEGFR-1 eta VEGFR-2 Zelula endotelialen azalean kokatuta. PlGF eta VEGF-B tirosin kinasa hartzaileari soilik lotu VEGFR-1, zeinak, zelula endotelialen azalean egoteaz gain, leukozitoen azalean ere badago. Hartzaileen gehiegizko aktibazioa VEGF-A neovaskularizazio patologikoa ekar dezake eta iragazkortasun iragazkortasuna areagotzea. PlGF Hanturazko zelulek neovaskularizazio patologikoaren eta tumorearen infiltrazioaren garapenarekin ere zerikusia dute.
Aflibercept-ek lotzen duen tranpa-hartzaile disolbagarria da VEGF-A jatorrizko errezeptoreak baino afinitate handiagoa dutenak VEGF-AHonetaz gain, erlazionatutako ligekin ere lotzen da VEGF-B eta PlGF. Aflibercept gizakiarekin lotzen da VEGF-A, VEGF-B eta PlGF jarduera biologikorik ez duten konplexu inerte egonkorrak eratuz. Ligan ligetarako tranpa gisa jardutea, aflibercept-ek ligando endogenoak dagozkien hartzaileei lotzea eragozten du eta, beraz, errezeptore horien bidez seinaleztapena blokeatzen du.
Aflibercept-ek hartzailearen aktibazioa blokeatzen du VEGF eta zelula endotelialen ugaritzea, tumoreari oxigenoa eta mantenugaiak hornitzen dituzten ontzi berrien eraketa inhibituz.
Aflibercept lotuta dago VEGF-A gizakia (oreka disoziazio konstantea (Cd) - 0,5 pmolorentzat) VEGF-A165 eta 0,36 pmol-rako VEGF-A121), s PlGF pertsona (cd 39 pmol for PlGF-2), s VEGF-B gizakia (Cd 1,92 pmol), zehaztu daitekeen jarduera biologikorik ez duen konplexu inerte egonkor bat eratuz.
Saguetan xenograft edo alograft tumoreekin aflibercept erabiltzeak hainbat adenokarkinoma motaren hazkundea galarazi zuen.
Minbizia koloretako koloreko minbizia (MKRP) duten kimioterapiak dituzten oxaliplatinak (aurretik bevacizumab-eko administrazioa) edo tratamenduarekin tratatu duten pazienteetan, Zaltrap ® / kimioterapiaren erregimenaFOLFIRI (fluorouracil, irinotecan, kaltzio folinatua) bizi itxaropenaren hazkunde estatistikoki esanguratsua erakutsi da erregimen kimioterapeutikoarekin alderatuta FOLFIRI.
Farmakozinetika
Absorption. Tumore-ereduetan egindako azterketa preklinikoetan, aflibercept biologikoki aktiboak diren dosiak erlazionatu ziren zirkulazio sistemikoan zirkulatzen duten aflibercept askearen kontzentrazioak sortzeko behar diren dosiekin, afibercept zirkulazio sistemikoan zirkulatzen duten aflibercept kontzentrazioak gaindituz. VEGF. Lotutako zirkulazio sistemikoarekin lotzen diren kontzentrazioak VEGF aflibercepta bere dosiaren gehikuntza gehitzen da gehienera arte VEGF konektaturik ez egotea.Aflibercept dosiaren gehikuntza batek aflibercept librearen zirkulazio sistemikoan zirkulazio sistemikoko kontzentrazioaren dosieraren menpe egotea eta soilik lotutako kontzentrazioaren gehikuntza besterik ez dakar. VEGF aflibercept.
Pazienteetan, Zaltrap ® 4 mg / kg iv-ko dosian ematen da 2 astean behin; horretan, aflibercept askean zirkulatzen den kontzentrazioaren gehiegizko krisia dago. VEGF.
Bi astean behin 4 mg / kg-ko gomendatutako dosian, aflibercept librearen kontzentrazioa C-ren baloreetatik gertu dagoss bigarren tratamendu zikloan lortu ziren ia metaketarik gabe (oreka 1,2 metatzeko koefizientea, lehen injekzioan aflibercept librearen kontzentrazioarekin alderatuta).
Banaketa. Vss aflibercepta doan 8 litro da.
Metabolismoa. Aflibercept proteina denez, ez da haren metabolismoaren ikerketarik egin. Aflibercept peptido txikietan eta aminoazido bakarrean banatuko dela espero da.
Kentzea. Zirkulazio sistemikoan zirkulatzen den aflibercept askeak bat egiten du batik bat VEGF-familia konplexuak ez diren aktibo egonkorrak eratzea. Espero da horrekin lotutako beste proteina handi batzuen antzera VEGF eta aflibercept librea zirkulazio sistemikotik pixkanaka ezabatuko da beste mekanismo biologiko batzuen bidez, adibidez katabolismo proteolitikoa.
2 mg / kg gainditzen duten dosietan, aflibercept librearen garbiketa 1 l / eguneko azken T izan zen1/2 6 egun
Pisu molekular altuko proteinak ez dira giltzurrunak kanporatzen, beraz, espero da aflibercept-aren giltzurrunaren gutxitzea.
Linealtasuna / ez-linealtasuna ezabatzea. Fliberceptcept-ek bere helburuarekin lotzen duen loturarekin (endogenoa) VEGF) 2 mg / kg-ko dosietatik beherako aflibercept libreak beherakada bizkorra (ez lineala) erakutsi zuen zirkulazio sistemikoan, itxuraz endogenoari lotzen zaion afinitate altuarekin VEGF. 2 eta 9 mg / kg bitarteko dosian, aflibercept librearen garbiketa lineala bihurtzen da, itxuraz kanporatze biologiko insaturatuen mekanismoengatik, proteina-katabolismoa adibidez.
Gaixo talde bereziak
Haurrak. Zaltrap ® sendagaia sartzean edo 2, 2,5, 3 mg / kg dosi bi astean behin. Tumore sendoak dituzten 8 paziente pediatriko (5 eta 17 urte bitartekoak), T batez bestekoa1/2 aflibercept librea, lehenengo dosiaren ondoren zehaztua, gutxi gorabehera 4 egun (3 eta 6 egun) zen.
Adineko gaixoak. Adinak ez du afiberbceptoaren farmakokinetika eragiten.
Identitate sexuala. Flibercept libre eta V garbitzeko desberdintasunak izan arrend gizonezkoetan eta emakumezkoetan ez da sexuarekin erlazionatutako bere esposizio sistemikoan desberdintasunak 4 mg / kg-ko dosian aplikatu zirenean.
Gorputz-masaren indizea. Gorputz-masak aflibercept askeak eta V-k eragindako eragina izan zuend Horrela, 100 kg baino gehiagoko gorputzaren pisua duten pazienteetan, aflibercept-en esposizio sistemikoa% 29 hazi zen.
Arrazakeria. Arrazakotasuna eta etnia ez zituen afibercept-en farmakoinetikak eragin.
Gibeleko gutxiegitasuna. Gibeleko gutxiegitasuna duten gaixoetan Zaltrap ®-en erabilera formalak ez dira egin.
Arinak (guztira bilirrubinaren kontzentrazioa odolean ≤1,5 VGN edozein ACT jardueraren balioetan) eta ertainean (bilirrubinaren kontzentrazio totala odoletan> 1,5-3 VGN ACT-en edozein baloreetan), gibeleko porrotak ez du aldaketarik izan garbitzean. . Ez dago daturik afibercept-aren farmakokinetikoei buruzko narriadura hepatikoa larria duten gaixoetan (odolean bilirrubinaren guztizko kontzentrazioa> 3 VGN-ren ACT jardueraren balioetan).
Giltzurruneko porrota. Giltzurrun-gutxiegitasuna duten gaixoetan Zaltrap ®-en erabilera formalak ez dira egin.
Ez da alderik aurkitu afibercept librearen esposizio sistemikoan (AUC), larritasun maila desberdinetako giltzurruneko porrota duten gaixoetan, 4 mg / kg-ko dosian.
Haurdunaldia eta edoskitzea
Ez dago daturik haurdun dauden emakumeetan aflibercept erabileraren inguruko datuei buruz. Animalietan egindako ikerketek eragin enbriotoxikoak eta teratogenoak agerian utzi dituzte afliberceptan. Angiogenesiak garrantzi handia du enbrioia garatzeko, angiogenesiak Zaltrap ®-ekin batera inhibitzeak haurdunaldiaren garapenerako ondorio kaltegarriak ekar ditzake. Ez da gomendatzen Zaltrap ® haurdunaldian eta haurdun egon daitezkeen emakumeen kasuan.
Haurtzaroko adingabeei Zaltrap ® tratamenduan zehar haurdunaldia ekiditeko gomendatu behar zaie eta Zaltrap ® fetuaren gainean eragin kaltegarriak izan ditzaketela jakinarazi behar zaie.
Haur adingabeak eta gizon emankorrak diren emakumeek antisorgailu metodo eraginkorrak erabili beharko dituzte tratamenduan zehar eta gutxienez 6 hilabetetan.
Ugalkortasunarekin nahastuta egoteko aukera dago gizonezko eta emakumezkoetan aflibercept-ekin tratamenduan (tximinoei buruz egindako ikerketetan lortutako datuetan oinarrituz; aflibercept-ek gizonezkoetan eta emakumezkoetan emankortasun urria eragin zuen, guztiz itzulgarria 8-18 aste ondoren).
Zaltrap ®-ek bularreko esnearen ekoizpenean, bularreko esnetan afibercept askatzea eta haurtxoetan duen eragina ebaluatzeko ikerketa klinikoak ez dira egin.
Ez dakigu aflibercept bularreko esnetan kanporatzen den ala ez. Hala ere, ezinezkoa delako afibercept bularreko esnetan sartzea baztertzea, baita haurtxoetan aflibercept-ek eragindako erreakzio larriak garatzeko aukera ere, beharrezkoa da edoskitzeari uko egitea edo Zaltrap ® ez erabiltzea (arabera. amak drogak erabiltzearen garrantzia).
Bigarren mailako efektuak
Kontrako erreakzio ohikoenak (HP) (larritasun-maila guztietakoak,% ≥20ko maiztasuna dutenak), gutxienez% 2 maiz antzeman dira Zaltrap ® kimioterapia-erregimena aplikatzeanFOLFIRIkimioterapia erregimenarekin baino FOLFIRIhonako hauek ziren HP (intzidentzia jaitsi ahal izateko): leukopenia, beherakoa, neutropenia, proteinuria, ACT jarduera handitu, estomatitis, nekea, trombocitopenia, ALT jarduera handitu, odol presioa handitu, gorputz pisua gutxitu, gosea gutxitu, sudurreko minak, sabeleko minak, disfonia, serum kreatininaren kontzentrazioa eta buruko mina areagotzea.
3-4 graduko larritasuna duen HP ohikoena (% ≥5eko maiztasunarekin), gutxienez% 2 maiz antzematen da Zaltrap ® kimioterapia-erregimena aplikatzeanFOLFIRI kimioterapia erregimenarekin alderatuta FOLFIRIhonako HP izan ziren (agerraldi-ordena murriztuz): neutropenia, beherakoa, hipertentsioa, leuzopenia, estomatisa, nekea, proteinuria eta astenia.
Orokorrean, gertakari kaltegarriak (larritasun maila guztiak) direla eta, terapia eten zen, Zaltrap ® / kimioterapiaren erregimena jaso zuten gaixoen% 26,8anFOLFIRI, kimioterapia-eskema jasotzen duten gaixoen% 12,1ekin alderatuta FOLFIRI. HP ohikoena, Zaltrap ® kimioterapia-erregimena jaso duten gaixoen% ≥1ean terapiari uko egiteko arrazoia izan zena.FOLFIRIhauek ziren: astenia / nekea, infekzioak, beherakoa, deshidratazioa, hipertentsioa, estomatitisak, konplikazio tromboemboliko venosoak, neutropenia eta proteinuria.
Zaltrap ® sendagaiaren doikuntza (dosia murriztea eta / edo omisioak)% 16,7an egin zen. Zaltrap ® kimioterapia erregimena jasotzen zuten gaixoen% 59,7an 7 egun baino gehiagoko terapia zikloak atzeratu zirenFOLFIRIkimioterapia-erregimena duten gaixoen% 42,6rekin alderatuta FOLFIRI.
Erregimen kimioterapéutikoaren azken zikloaren ondorengo 30 egunen buruan gaixotasunaren aurrerakuntzaz gain, Zaltrap ® kimioterapia erregimena jaso duten gaixoen% 2,6an erregistratu zen.FOLFIRIeta kimioterapia-erregimena jasotzen duten gaixoen% 1ean FOLFIRI. Kaltra kimioterapia erregimena jasotzen duten gaixoen heriotza-arrazoia /FOLFIRIhonako hauek izan ziren: infekzioa (sepsi neutropenikoa barne) 4 gaixoetan, deshidratazioa 2 gaixoetan, hipovolemia 1 pazienteetan, entzefalopatia metabolikoa 1 gaixoan, arnas bideetako gaixotasuna (arnas gutxiegitasun akutua, aspirazio pneumonia eta biriketako embolia) 3 gaixoak, traktu gastrointestinalaren nahasteak (ultzera duodenalaren hemorragia, tratamendu gastrointestinalaren hantura, hesteetako obstrukzio osoa) 3 gaixoetan, arrazoi ezezagunak heriotza 2 gaixoetan.
Jarraian, Zaltrap ® kimioterapia erregimena jasotzen duten pazienteen laborategiko parametroen anormalitateak eta /FOLFIRI beren sistemako organo klaseetan banatu dute Jarduera Medikoen Hiztegia jarduera arautzaileen sailkapenarekin bat etorriz MedDRA.
Jarraian aurkezten diren HPak nahigabeko erreakzio kliniko edo anormalitate gisa definitu dira laborategiko parametroetan ≥2% maiztasun handiagoa dutenak (larritasun maila guztietako HPentzat) aflibercept taldean, plazeboko taldearekin alderatuta, ICP duten pazienteetan egindako ikerketa batean. HP intentsitatea arabera sailkatu zen NCI CTC (Minbiziaren Institutu Nazionalaren Terminologia Orokorreko IrizpideakAEBetako Minbiziaren Minbiziaren Institutuaren Toxikotasun Kalifikazio Eskala Orokorra) 3.0 bertsioa.
HP intzidentzia OMS sailkapenaren arabera zehaztu zen honela: oso maiz -% ≥10, askotan - ≥1– barne. ≥3 larritasuna).
Odol eta linfa sistemaren aldetik: oso maiz - leuzopenia (larritasun maila guztietako, ≥3ko larritasun maila barne), neutropenia (larritasun maila guztietako, ≥3ko larritasun maila barne), tronbozitopenia (larritasun maila guztiak), maiz - neutropenia febrila (larritasun maila guztietakoak, ≥3 larritasun maila barne), tronbozitopenia (≥3 larritasun maila).
Sistema immunologikotik: maiz - hipersentsibilitate erreakzioak (larritasun maila guztiak), gutxitan - hipersentsibilitate erreakzioak (≥3garren larritasuna).
Nahaste metaboliko eta nutrizionalak: oso maiz - gosea gutxitzea (larritasun maila guztiak), maiz - deshidratazioa (larritasun maila eta ≥3 larritasun maila), gosea gutxitzea (≥3 larritasun maila).
Nerbio sistematik: oso maiz - buruko mina (larritasun maila guztietakoa), maiz - buruko mina (≥3 larritasun maila), gutxitan - POPak.
Ontzietatik: oso maiz - odol-presioaren gehikuntza (larritasun-maila guztietako kopurua) (odol-presioaren gehikuntza izan duten gaixoen% 54an (≥3 larritasun-maila), lehen bi tratamendu zikloetan garatutako odol-presioaren hazkundea), hemorragia / hemorragia (larritasun maila guztietakoak), odoljario mota ohikoena sudurreko hazi txikiak izan ziren (1-2 larritasuna), askotan arterial konplikazio tromboembolikoak (ATEO) (hala nola, istripu zerebrobaskular akutuak, izozteko eraso zerebrobaskular iskemikoak, angina pectoris, intracardiac t osagaia, miokardioko infartua, tromboembolismo arteriala eta kolitis iskemikoa) (larritasun-maila guztiak), konplikazio tromboemboliko venosoak (zain tronbosi sakona eta biriketako embolismoa) larritasun-maila guztietako, odoljarioa (≥3 larritasun-maila, batzuetan fatala) barne. - hesteetako odoljarioa, hematuria, odoljarioa prozedura medikoen ondoren, maiztasuna ez da ezagutzen - Zaltrap ® jasotzen duten pazienteetan, intrakraniako hemorragia larria eta biriketako hemorragia / hemoptisia garatu dira. . larria.
Arnas sistematik, bularreko eta hesteetako organoak: oso maiz - arnasa gutxitasuna (larritasun-maila guztietakoa), sudur-hazteak (larritasun-maila guztietakoak), disfonia (larritasun-maila guztietakoak), maiz - orofaringe-mina (larritasun-maila guztiak), rinoreea (1-2 larritasun bakarraren rinoreea ikusi zen) , gutxitan - arnasa gutxitasuna (≥3 larritasun maila), sudurreko hazkundea (≥3 larritasun maila), disfonia (≥3 larritasun maila), orofaringe mina (≥3 larritasun maila).
Tratamendu gastrointestinala: oso maiz - beherakoa (larritasun maila guztietatik ≥3ko larritasuna barne), estomatitisak (larritasun maila guztietakoak, ≥3ko larritasuna barne), sabeleko minak (larritasun maila guztietakoak), mina goiko sabelaldea (larritasun maila guztiak), askotan - sabeleko minak ≥3 larritasun maila, goiko sabelean mina (≥3 larritasun maila), hemorroideak (larritasun maila guztiak), rectumetik odoljarioa (larritasun maila guztiak) , mina rectumean (larritasun maila guztiak), haginetako minak (larritasun maila guztiak), estomatitis aftosa (larritasun maila guztiak), irudiak fistulak (anal, heste-gernu txikiak, kanpoko heste txikiak (heste-larruazal txikia), heste-baginala, heste artekoak) (larritasun maila guztiak), gutxitan - fistula gastrointestinala eratzea (≥3 larritasun maila), traktu gastrointestinalaren hormak zulatzea (guztiak larritasun-maila, ≥3 larritasun-maila barne, hodietako gastrointestinalaren hormen zulaketa latza barne, rectumetik odoljarioa (≥3 larritasun maila), estomatitis aftosa (≥3 larritasun maila), mina rectumean ( ≥3 larritasuna).
Larruazalaren eta larruazalpeko ehunen aldetik: oso maiz - palmondo-landare eritrodisestesia sindromea (larritasun maila guztiak), maiz - larruazaleko hiperpigmentazioa (larritasun maila guztiak), palmar-plantar eritrodisestesia sindromea (≥3ko larritasuna).
Giltzurrunak eta gernu-traktuak: oso maiz - proteinuria (laborategi eta laborategiko datu konbinatuen arabera) (larritasun gradu guztiak), serum kreatininaren kontzentrazioaren gehikuntza (larritasun maila guztiak), maiz - proteinuria (≥3 larritasun maila), gutxitan - sindrome nefrotikoa. Proteinuria eta odol-presioa areagotu zuten paziente batek Zaltrap ® kimioterapia erregimenarekin tratatutako 611 gaixoetatikFOLFIRI, mikroangiopatia tronbotikoa diagnostikatu zioten.
Injekzio gunean nahaste orokorrak eta erreakzioak: oso maiz - baldintza astenikoak (larritasun maila guztiak), nekearen sentsazioa (larritasun maila guztiak, ≥3 larritasun maila barne), maiz - baldintza astenikoak (≥3 larritasun maila), gutxitan - zauriak sendatzea ( zauriaren ertzen desadostasuna, anastomosen porrota) (larritasun maila guztiak, ≥3 larritasun maila barne).
Laborategiko eta instrumentaleko datuak: oso maiz - ACT jarduera, ALT (larritasun maila guztiak), gorputz pisua gutxitu (larritasun gradu guztiak), askotan - ACT jarduera, ALT (≥3rren larritasun maila), gorputz pisua gutxitu (≥3rren larritasun maila) .
HP maiztasuna paziente talde berezietan
Zahartzaroa Adineko pazienteetan (≥ 65 urte), beherakoa, zorabioak, astenia, pisu galera eta deshidratazioen intzidentzia adin txikiagoko pazienteetan baino% 5 handiagoa zen. Adineko gaixoek estuki kontrolatu behar dute beherakoa eta / edo deshidratazio posibleak garatzeko.
Giltzurruneko porrota. Giltzurruneko narriadura arina duten pazienteetan Zaltrap ® erabiltzen hasi zenean, HPren intzidentzia Zaltrap ® erabiltzeko unean giltzurruneko funtzio okerrik ez zuten gaixoen parekoa zen. Giltzurruneko narriadura moderatua eta larria duten pazienteetan, giltzurruna ez den HP-ren agerraldia giltzurruneko porrotik gabeko gaixoen kasuan parekoa izan zen, gutxienez>% 10eko deshidratazio tasa (larritasun maila guztiak) izan ezik.
Immunogenizitate. Gainerako proteina drogak bezala, aflibercept immunogenoak izateko arrisku potentzial bat du.Oro har, saiakuntza kliniko onkologiko guztien emaitzen arabera, gaixoetako inork ez zuen aflibercept antigorputzetarako titulu handia erakutsi.
Merkaturatzea ondoren drogaren erabilera
Bihotzetik: maiztasun ezezaguna - bihotz gutxiegitasuna, ezkerreko bentrikuluaren egituraketaren beherakada.
Ehun muskulo-eskeletikoaren eta konektiboaren aldean: maiztasun ezezaguna - masailezur osteonekrosia. Afliberzeptiboa hartzen duten pazienteetan, masailezur osteonekrosi kasuak jakinarazi dira, batez ere masailezur osteonekrosi izateko arrisku faktore jakin batzuk dituzten pazienteetan, hala nola bisfosfonatoak eta / edo hortz prozedura inbaditzaileak.
Dosierra eta administrazioa
B /, 1 orduko infusio moduan eta ondoren, kimioterapéutikoen erregimena sartu ondoren FOLFIRI. Zaltrap ® dosi gomendagarria, erregimen kimioterapeutikoarekin batera erabiltzen dena FOLFIRI4 mg / kg da.
FOLFIRI kimioterapiaren erregimena
Zikloaren lehenengo egunean - aldi bereko iv infusioa, Irinotecan Y formako kateter baten bidez, 180 mg / m 2-ko dosian 90 min eta kaltinazko folinatua (ezkerreko eta eskuineko racemates) 400 mg / m 2-ko dosian 2 h, s ondorengo iv (bolus) fluorouracil administrazioa 400 mg / m 2-ko dosian, eta jarraian fluorouracil barneko barne infusio jarraitua 2400 mg / m 2-ko dosian 46 orduz
Kimioterapia zikloak 2 astean behin errepikatzen dira.
Zaltrap ®-rekin tratamendua gaixotasunak aurrera egin arte edo onartezina den toxikotasuna garatzen jarraitu behar da.
Dosifikazio-erregimena / tratamendua atzeratzeko gomendioak
Zaltrap ®-rekin tratamendua eten behar da kasu hauetan:
- hemorragia larriaren garapena
- tratamendu gastrointestinalaren hormen zulaketaren garapena;
- krisi hipertentsiboa edo entzefalopatia hipertentsiboa garatzea,
- arterial tromboemboliko konplikazioak garatzea;
- sindrome nefrotikoa edo mikroangiopatia tronboziala garatzea;
- Hipersentsibilitate erreakzio larriak garatzea (bronkospasmoa, arnasaren gabezia, angioedema, anafilaxia);
- zauriak sendatzea, esku-hartze medikoa behar izatea;
- posterior encefalopatia sindromea itzulgarria (POPak) garatzea, ondorengo leukoencefalopatia itzulgarria (POP) izenez ere ezaguna.
Aurreikusitako ebakuntza egin baino 4 aste lehenago, Zaltrap ®-rekin tratamendua aldi baterako eten behar da.
| Zaltrap ® / FOLFIRI kimioterapia atzeratua | |
| Neutropenia edo tronbozitopenia | Zaltrap ® kimioterapia erregimenaren erabileraFOLFIRI atzeratu egin behar da odol periferikoko neutrofiloen kopurua ≥1.5 · 10 · 9 arte eta / edo odol periferikoko plaketen kopurua ez ≥75 · 10 9 / l arte handitu arte. |
| Hipersentsibilitate erreakzio arinak edo moderatuak (larruazala, erupzioak, urtikaria eta pruritoa barne) barne. | Tratamendua eten egin behar da erreakzioa eten arte. Beharrezkoa bada, hipersentsibilitate erreakzioa geldiarazteko, posible da GCS eta / edo antihistaminak erabiltzea. Ondorengo zikloetan, GCS eta / edo antihistaminikoen premedikazioa har daiteke |
| Hipersentsibilitate erreakzio larriak (bronkospasma, dispnea, angioedema eta anafilaxia barne) | Zaltrap kimioterapiaren erregimena eten egin behar daFOLFIRI eta hipersentsibilitate erreakzioa gelditzea helburu duen terapia egitea |
| Zaltrap ®-rekin tratamendua geroratzea eta dosia egokitzea | |
| Odol presioa handitzea | Zaltrap ® sendagaiaren erabilera aldi baterako eten behar da hipertentsio arterialaren kontrola lortu arte. Odol presioaren gehikuntza nabarmen errepikatzen den neurrian, drogaren erabilera eten egin behar da hipertentsioaren gaineko kontrola lortu arte eta, ondorengo zikloetan, Zaltrap ® dosia 2 mg / kg murriztu. |
| Proteinuria (ikusi "Argibide bereziak") | Zaltrap ® erabilera proteinuria ≥2 g / eguneko eten daiteke. Tratamendua berriz proteinuria ® jaitsi ondoren proteinuria ® jaitsi arte berrabia daiteke |
| Estomatitis gogorra eta palmar-plantar eritrodisestesia sindromea | Fluorouracilaren bolus eta infusio dosia% 20 murriztu behar dira |
| Beherakoa larria | Irinotecan dosia% 15-20 murriztu behar da. Beherakoa larria behin eta berriz agertzen bada, hurrengo zikloan, gainera, fluorouracilaren bolus eta infusio dosia% 20 murriztu beharko lirateke. Beherakoa larriak bi drogen bi dosi murrizten jarraitzen badu, eten egiten da FOLFIRI. Beharrezkoa bada, antidiarrealen aurkako tratamendua eta likidoen eta elektrolitoen galerak berrezarri daitezke. |
| Neutropenia febrila eta sepsi neutropenikoa | Hurrengo zikloetan, irinotecan dosia% 15-20 murriztu behar da. Ondorengo zikloetan garapen errepikatuarekin, bolo eta infusio dosi% 20 murriztu beharko lirateke. G-CSF aplikazioa kontuan hartu daiteke. |
Irinotecan, fluorouracil eta kaltzio folinateen toxikotasunari buruzko informazio gehiago lortzeko, ikusi haien erabilerarako argibideak.
Gaixo talde bereziak
Haurrak. Segurtasuna eta eraginkortasuna ez dira ezarri paziente pediatrikoetan.
Segurtasun eta tolerantzia dosi gehikuntzarekin, 2 eta 21 urte bitarteko 21 gaixoek (12,9 urte bitarteko adina) tumore solidoak jaso zituzten Zaltrap ® 2 eta 3 mg / kg iv dosi bi astean behin. Aflibercept askeko parametro farmakokinetikoak paziente horietako 8 ebaluatu ziren (5 eta 17 urte bitartekoak) ikusi Farmakokinetika, azpiatala "Gaixo talde bereziak". Ikerketan onartutako gehienezko dosia 2,5 mg / kg-ko dosia izan zen, minbizi koloretako metastatikoa duten helduentzako dosi segurua eta eraginkorra baino txikiagoa.
Adineko gaixoak. Adineko gaixoek ez dute Zaltrap ® dosiaren doikuntza behar.
Gibeleko gutxiegitasuna. Gibeleko gutxiegitasuna duten gaixoetan Zaltrap ®-en erabilera formalak ez dira egin. Datu klinikoen arabera, gibeleko gutxiegitasun arina edo moderatua duten pazienteetan aflibercept-en esposizio sistemikoa gibeleko funtzio normala duten gaixoen antzekoa zen.
Froga klinikoek adierazten dute ez dela beharrezkoa afiberceptcept-en dosi doikuntza gibeleko gutxiegitasun arina edo moderatua duten gaixoetan.
Ez dago daturik hepatia larria duten gaixoetan aflibercept erabiltzearen inguruko datuei buruz.
Giltzurruneko porrota. Giltzurruneko funtzio urria duten pazienteetan Zaltrap ® erabiltzeari buruzko azterlan formalak ez dira egin. Datu klinikoetan oinarrituz, giltzurrun-gutxiegitasun arina edo moderatua duten pazienteetan aflibercept-en esposizio sistemikoa giltzurrun-funtzio normala duten gaixoen antzekoa zen.
Froga klinikoek iradokitzen dute afiberbceptcep hasierako dosia zuzentzea giltzurruneko gutxiegitasun arina edo moderatua duten pazienteetan ez dela beharrezkoa. Giltzurruneko gutxiegitasun larria duten pazienteetan drogaren erabilerari buruzko datu gutxi dago, beraz, horrelako pazienteetan droga erabiltzerakoan kontuz ibili behar da.
Irtenbideak prestatzeko eta horiek sartzeko gomendioak
Droga antitumoralen erabilerari buruzko esperientzia duen sendagile baten kontrolpean erabili behar da.
Ez injektatu diluitu kontzentratua. Ez injektatu iv jet batean (ez azkarra ezta motela ere).
Zaltrap ® ez dago barneko administrazioarentzat.
Prestaketa parenterale guztiekin gertatzen den bezala, administrazioa egin aurretik, Zaltrap ® disoluzio disoluzioa ikusmen ikuskatu behar da ezezagunak diren partikulak edo deskoloratzeak egon daitezen.
Zaltrap ® soluzio diluituak IV infusio multzoak administratu behar dira, dietilhexil ftalatoa (DEHP) duten PVCz egindakoak, PVCak ez DEHP dituztenak, baina trioktiltiltrimelatoa (TOTM), polipropilenoa, PEak, PVC barruan estalitakoak, poliuretanikoak.
IV infusio kitek polietersulfona iragazkiak izan beharko dituzte, 0,2 mikrako diametroko poroak dituztenak. Ez erabili poliviniliden fluoruroa (PVDF) edo nilonezko iragazkiak.
Bateragarritasun azterketen gabezia dela eta, Zaltrap ® ez da beste sendagai edo disolbatzaileekin nahastu behar,% 0,9 sodio kloruroaren disoluzioa eta% 5 dextrosa disoluzioarekin.
Infusioaren soluzioa prestatzea eta manipulatzea
Zaltrap ® droga infusioaren konponbidea mediku profesional batek prestatu behar du baldintza aseptikoetan manipulatzeko prozedura seguruak betez.
Ez erabili botila botikarekin kontzentrazioaren soluzioak disolbatu gabeko partikulak baldin baditu edo bere kolorea aldatzen bada.
DEHP edo poliolefina duten PVCarekin egindako infusio ontziak erabili behar dira (PVC eta DEHF gabe).
Zaltrap ® kontzentratuaren hiperosmolaritatearen (1000 mosmol / kg) hiperosmolaritatearen eraginez soilik.
Droga ez da injekziora zuzentzen gorputz barentsean.
Zaltrap ® drogaren kontzentratua diluitu behar da. Kendu Zaltrap ® kontzentratua behar den kantitatea eta diluitu behar den bolumena injektatzeko% 0,9 sodio kloruro soluzioarekin edo injekziorako 5% dextrose soluzioarekin.
Zaltrap ® kontzentratua diluitu ondoren infusio disoluzioaren kontzentrazioan 0,6–8 mg / ml bitartekoa izan beharko litzateke.
Ikuspegi mikrobiologikotik, Zaltrap ® disoluzio diluitua berehala erabili behar da, haren egonkortasun fisikoa eta kimikoa 24 orduz mantendu behar da 2-8 ºC-ko tenperatura eta gehienez 8 ordu 25 ºC-ko tenperaturara.
Zaltrap ® drogako ontziak erabilera bakarrekoak dira. Ontziaren erabilerarik gabeko botika guztia Errusiako eskakizun egokien arabera bota behar da. Ez ezazu berriro zuloa tapoia berriro orratza sartu eta gero.
Gaindosi
2 astean behin 7 mg / kg gainditzen duten dosietan Zaltrap ® hartzeko segurtasunari buruzko informaziorik ez dago 3 astean behin.
sintomak: dosi-erregimen hauekin ikusitako HP ohikoena drogarekin ikusitako dosi terapeutikoetan antzekoa izan zen.
tratamendua: mantentze terapia beharrezkoa da, batez ere hipertentsioaren eta proteinuria areagotzea eta tratatzea. Zaltrap ®-entzat ez dago antidoto zehatzik Gaixoak gainbegiratze medikoa izan behar du "Bigarren mailako efektuak" atalean deskribatutako edozein HP identifikatzeko eta kontrolatzeko.
Kaleratze orria
Infusiorako irtenbide kontzentratua, 25 mg / ml. Drogaren 4 ml kolorerik gabeko edalontziko botila batean (I mota), bromobutilazko gomazko tapoi batekin aluminiozko kortxete batekin estalitako eraztunarekin eta zigilatzeko disko batekin. 1 edo 3 fl. kartoizko sorta batean. Sendagaiaren 8 ml kolorerik gabeko edalontzi botila batean (I mota), bromobutilazko gomazko tapoi batekin aluminiozko kortxete batekin estalitako eraztunarekin eta zigilatzeko disko batekin. 1 fl. kartoizko sorta batean.
Erabilerarako argibideak Zaltrap
Substantzia aktiboa: aflibercept 25 mg
excipients: sodio fosfato monohidratoa (E339), sodio hidrogeno fosfato heptahidrato (E339), azido zitrikoa monohidrato (E330), sodio zitrato dihidratatu (E331), sodio kloruro granularra, sakarosa, Polisorbato 20 (E433), azido klorhidrikoa% 36 (E507), sodio hidroxidoa (E524), injekziorako ura.
Deskribapena. Kolorerik gabeko likido gardena edo horia zurbila, ezpurutasun mekanikorik gabe.
Drogaren deskribapena

Droga agente antitumoralen taldekoa da. Kontzentratu moduan sortzen da, eta honetatik infusiorako soluzioak prestatzen dira. Jabetzarik gabeko nazioarteko izena aflibercept da. Merkataritza-izenak Zaltrap eta Eilea dira.
Erabilerarako adierazpenak
Aldi berean, azido foliniko, irinotecan eta fluorouracil dosi jakin bat hartzen da. Osagai horiek guztiak kimioterapiarako erabiltzen dira koloreko minbizia duten gaixoetan, beste antitumoralen aurkako erresistentzia handia erakusten duenean. Halaber, "Zaltrap" erorketa egiteko erabiltzen da.

Aflibergioaren ekintza farmakologikoa
Afiberbiseptearen eraginpean, odol hodi berriak eratzen dituzten hartzaileek elikadurarako eta tumorearen hazkundea hobetzen dutenek ez dute jarduten. Odol isuri nahikoa ez denez, neoplasia neurrian apurka-apurka jaitsi egiten da, zelula atipikoek zatitzen eta hazten uzten dute.

Ez dago eskuragarri aflibercept proteinaren metabolismoari buruzko informazioa. Zientzialariek iradokitzen dute aminoazidoetan eta peptidoetan zatitzen dela. Osagai aktiboa sei egunez gorputzetik kanporatzen da gantzen bidez. Giltzurrunak ez dute funtsak kentzerakoan parte hartzen.
"Zaltrap" erabiltzeko jarraibideak
Droga ordubetez injektatzen da zainetan. Dosia gorputzeko pisu kilogramo bakoitzeko 4 mg kalkulatzen da. Erregimen kimioterapeutikoa honako hau izango da:
- Tratamenduaren lehenengo egunean, Y itxurako kateterra erabiltzen da. Hiru barneko infusioak egiten dira irinotecan konbinatuz. Prozedurak 90 minutu irauten du. Kaltzio folinatua bi orduz administratzen da 400 mg eta fluorouracil kantitate berean,
- Hurrengo infusioa etengabea izango da 46 orduz. Kasu honetan, fluorouracil 2400 mg-ko dosian ematen da.
Tratamendu ziklo hau bi astean behin errepikatzen da. Diabetesa duten pertsonentzat, dosia ez da aldatu behar.
Praktika kimioterapeutikoan esperientzia duen mediku batek egin behar du infusioa.

Inprimatu gabeko eta jet bidez, droga ez da inolaz ere administratu behar.
Erabili aurretik, konponbidea arretaz aztertu behar da. Itxura egokia izan beharko luke partikula uxatu gabe.
Ez erabili nylon edo poliviniliden fluoruro iragazkiak infusioetan.
Droga beste droga batzuekin konbinatzeari buruzko informaziorik ez dagoenez, substantziaren konbinazioa sodio kloruroaren edo dextrosaren soluzioarekin soilik onartzen da.
Medikuak soilik irtenbide bat prestatu behar du barne-hartzeetarako, asepseari buruzko arauak errespetatuz. Ez erabili ezezagunak diren partikulak dituen botila edo drogaren kolorea aldatu egin da. Diluzioa egin ondoren, aflibercept kontzentrazioa 0,6–8 mg / ml ingurukoa izan behar da. Bukatutako sendagaia berehala erabili behar da, egonkortasun fisikoa eta kimikoa zaintzea egunean zehar soilik ikus baitaiteke.
Non da hobe "Zaltrap" erostea, haren prezioa eta biltegia
Sendagaia erosi dezakezu farmazia batean. Horretarako, medikuaren errezeta eman behar duzu. Hori gabe, drogearen salmenta baztertuta dago. Botika baten botila baten kostua 8500 errublokoa da.

Botika tenperatura 8 baino altuagoa eta 2 gradukoa baino txikiagoa ez den gela batean egon beharko litzateke. Sendagaiak ez dira eguzki-argiaren eraginpean egon behar.
Sendagaia ekoizten denetik hiru urtera gorde dezakezu. Epe hori igaro ondoren, ezin duzu drogarik erabili, beraz bota egin behar da.
"Zaltrap" ri buruzko iritziak
Nire aita tratatzen ari ziren gatzagaz tratatzen. Sendagai ona da, tumorearen aurka modu eraginkorrean jokatzen du, baina bigarren mailako efektuak beti gertatzen dira. Ona da bi astean behin injektatzea, aita oso zaila baitzen kimioterapia jasatea. Baina azterketek erakutsi zuten neoplasia gero eta txikiagoa dela.
"Zaltrap" -aren ondoren buruko mina, goragalea eta oka egiten nituen etengabe, lo egin nahi nuen etengabe. Baina drogak tumoreari oso azkar eragiten dio. Beraz, emaitza ona lortzeko, jasan dezakezu.
Nahiz eta droga nahiko garestia izan eta egoera ikaragarria da, baina benetan laguntzen du. Hainbat ikastaroren laguntzarekin ia tumorea kentzeko gai izan nintzen. Medikuek diotenez, berriro dago berriro aukerarik. Sendagai honen aurretik beste batzuek tratatu ninduten, baina horien eragina iraun zuen denbora gutxian. Zaltrap egin ondoren, ez dut minbiziaren arrastorik izan hainbat urtetan.
Oso eskertuko dugu sare sozialetan baloratu eta partekatu nahi baduzu
Askatu inprimakiak eta osaera
Infusiorako irtenbidea prestatu den kontzentratua. Ontziak 4 ml eta 8 ml bolumena dituzte. Aflibercept substantzia nagusiaren kantitatea 25 mg 1 ml da. Bigarren aukera prestatutako soluzio antzuena da, barneko administraziorako zuzendua. Soluzioaren kolorea gardena da edo horia zurbilarekin.
Osagai nagusia aflibercept proteina da. Salbuespenak: sodio fosfatoa, azido zitrikoa, azido klorhidrikoa, sakarosa, sodio kloruroa, sodio hidroxidoa, ura.
Aflibercept-ek hartzaileen lana blokeatzen du, tumorea elikatzen duten eta bere hazkunde intentsiboa laguntzen duten odol hodi berriak eratzeaz arduratzen direnak. Odol-horniketarik gabe, neoplasia tamaina txikitzen hasten da. Bere zelula atipikoen hazkuntza eta zatiketa prozesua gelditu egiten da.
Aflibercept-ek hartzaileen jarduera blokeatzen du, odol hodi berriak eratzeaz arduratzen direnak.
Arretaz
Giltzurrun-gutxiegitasuna, hipertentsio arteriala, bihotzeko gaixotasun koronarioak eta bihotz gutxiegitasunaren hasierako faseak dituzten osasun egoeraren jarraipen etengabea behar dira. Kontu handiz, sendagaia adineko pazienteei eta egoera orokorrean egoera txarra dutenei agindutakoa da, balorazio-eskala 2 puntu baino handiagoa ez bada.
Zaltrap nola hartu?
Barrualdeko administrazioa - 1 orduko infusioa. Batez besteko dosia gorputzeko pisu kilogramo bakoitzeko 4 mg da. Erregimen kimioterapeutikoa oinarri hartuta sinatu da tratamendua:
- lehenengo terapia eguna: barneko infusioa Y itxurako kateter batekin Irinotecan 180 mg / m² erabiliz 90 minutuz, kaltzio folatoa 120 minutuz 400 mg / m² eta 400 mg / m² fluorouracil,
- jarraian, infusio jarraian 46 ordu irauten du Fluorouracil 2400 mg / m²-ko dosi batekin.
Barrualdeko administrazioa - 1 orduko infusioa.
Ziklo bat errepikatzen da 14 egunez behin.
Tratamendu gastrointestinala
Beherakoa, intentsitate desberdineko sabeleko mina, hemorroideak garatzea, fistulak eratzea anusan, maskuriko, heste txikian. Arazo mina posibleak, estomitisak, zurrunbiloan, baginan. Digestio-sistemako fistulak eta hormen zulaketa gutxitan gertatzen dira eta horrek gaixoaren heriotza ekar dezake.
Arnas aparatuaren sintoma kaltegarriak: maiz gertatzen da dispnea.
Sistema kardiobaskularretik
Odol presioaren jauziak, barneko odoljarioak. Paziente askotan: tromboembolismoa, eraso iskemikoa, angina pektoriala, miokardioko infartua izateko arrisku handia. Gutxitan: hemorragia kraniozerebralen irekitzea, odol zuritzea, odoljario oparoa traktu gastrointestinalean, heriotzaren kausa.
Mekanismoak kontrolatzeko gaitasunean duen eragina
Ez dago drogak arreta kontzentrazioan izan dezakeen eraginari buruzko azterketari buruzko daturik. Gomendagarria da gidatzeari eta mekanismo konplexuei uko egitea, pazienteak nerbio-sistema zentralean eta arazo psikomotorrak dituzten bigarren mailako efektuak baldin baditu.
Terapia ziklo berri baten aurretik (14 egunean behin), odol azterketa egin behar da.
Terapia ziklo berri baten aurretik (14 egunean behin), odol azterketa egin behar da. Droga ospitale ezarpenetan ematen da, deshidratazio zantzuak, traktu gastrointestinalaren hormen zulaketa modu egokian erantzuteko.
Osasun indize orokorra duten 2 puntu edo gehiago dituzten pazienteek emaitza kaltegarriak izateko arriskua dute. Osasunean narriaduraren diagnostikoa egiteko diagnostiko etengabea behar dute.
Fistulak bere kokapena edozein dela ere, terapia berehala amaitzeko zantzuak dira. Debekatuta dago medikazioa erabiltzea interbentzio kirurgiko ugari egin dituzten gaixoen tratamenduan (zauriak erabat sendatu arte).
Haur adingabeak dituzten gizonek antisorgailu metodo ezberdinak erabili beharko dituzte Zaltrap azken dosiaren ondoren sei hilabeteko epean (ez gutxiago). haur baten ikuskera baztertu behar da.
Zaltrap soluzioa hiperosmotikoa da. Bere osaerak drogak espazio intraokularrean erabiltzea baztertzen du. Debekatuta dago soluzioa gorputz bernarian sartzea.
Erabilera zahartzaroan
65 urte edo gehiago dituzten pazienteetan beherakoa, zorabioak, pisu galera bizkorra eta deshidratazioa garatzeko arrisku handia dago. Saltrap terapia medikuen langileen gainbegiratzea baino ez da egin behar. Beherakoa edo deshidratazioaren lehen seinalean, berehala tratamendu sintomatikoa behar da.
Saltrap terapia medikuen langileen gainbegiratzea baino ez da egin behar.
Erabili haurdunaldian eta edoskitze garaian
Ez dago eskuragarri Zaltrap haurdun dauden eta edoskitzen duten emakumeen erabilerari buruzko datuak.
Haurrarengan ondorio negatiboak izan litezkeen arriskuak ikusita, antitumoral droga ez da gaixoen kategoria horietarako agindua eman.
Ez da informazioa botikaren osagai aktiboa bularreko esnetan xurgatzen den ala ez. Beharrezkoa bada, erabili erizaintzako minbiziaren tratamenduan sendagai bat, edoskitzea bertan behera utzi behar da.
Fabrikatzailea
Sanofi-Aventis Deutschland GmbH, Alemania.
Tumorearen aurkako terapia
Bitaminen efektu antitumoralak
Ksenia, 55 urte, Mosku: "Zaltrap ikastaroa aitak minbizia tratatzeko agindua eman zidan. Droga ona da, eraginkorra, baina oso zaila. Beti daude alboko sintomak. Ona da bi astean behin bakarrik ematen dela, kimioterapiaren ondoren aitaren egoerak aldi baterako okerrera egin baitu, baina azterketek neoplasia murrizteko joera positiboa erakutsi dute ".
Eugene, 38 urte, Astana: "Zaltrapen bigarren mailako efektuak asko sentitu nituen. Egoera ikaragarria zen: goragalea, gorakoa, buruko mina etengabea, ahultasun larria. Baina sendagaiak azkar jokatzen du tumorearen gainean. Minbiziaren tratamenduan duen erabilerak merezi du oinaze hau guztia ".
Alina, 49 urte, Kemerovo: "Hau droga garesti bat da, eta harekin kimioterapiaren ondoren egoera ere horrelakoa da ez dut nahi bizi. Baina eraginkorra da. 1 ikastaro batean, nire tumorea ia desagertu egin zen. Medikuak esan du badela berrezartzeko aukera, baina portzentaje txikia. Zaltrap baino lehen beste droga batzuk erabiltzen ziren, baina efektua iraupen gutxikoa izan zen, eta, ondoren, hiru urte daramatzat minbizi zantzurik gabe. "
Zaltrap injektagarria

Droga hau hartzen hasi aurretik, esan zure medikuari dagoeneko erabilitako sendagaiak, dieta osagarriak (adibidez, bitaminak, osagarri naturalak, etab.), Erreakzio alergikoak, dauden gaixotasunak eta gaur egungo osasun baldintzak (adibidez, haurdunaldia, hurrengo ebakuntza, etab.).
Drogaren bigarren mailako efektuak nabarmenagoak izan daitezke zure gorputzaren egoera jakin batean. Hartu medikua medikuak agindutako moduan edo jarraitu botikarekin emandako jarraibideak. Botikaren dosia zure egoeraren araberakoa da. Esan zure medikuari aldaketarik ez badago edo zure egoera okertzen ari dela.
Jarraian zerrendatzen dira zure osasun-laguntzailearekin eztabaidatzeko puntu garrantzitsuak.
- Zaharrak diren gaixoak beherakoa eta deshidratazioa kontrolatzeko
Gehiago jakin: Erabilera-neurriak eta arauak
Informazio hori lortzeko, kontsultatu zure medikuari, botikariari edo irakur ezazu produktuaren paketearen informazioa.
Zaltrap Injectable hurrengo paketeetan eskuragarri dago, intentsitate aukera hauekin
Erabilgarri dagoen Zaltrap-en paketagarria: 4MG
Botikak honako enpresek sortzen dituzte
- Baimendu al da industria astunerako ekipamenduak erabiltzea droga hau hartzen ari zaren bitartean? Zaltrap injektagarria hartzen ari zarenean loak, zorabioak, hipotentsioa edo buruko mina sentitzen baduzu, baliteke gidatzeari eta industria ekipamendu astunei uko egin behar izatea.
Botikak egiteari utzi behar diozu drogak hartuz gero, zorabiatu edo hipotentsio bihurtzen bazaitu. Medikuek gomendatzen dute horrelako drogekin alkohola erabiltzea gelditzea, izan ere alkoholak bigarren mailako efektuak eta larritasuna nabarmen hobetzen ditu. Mesedez, egiaztatu zure gorputzean efektu horiek Zaltrap Injectable erabiltzen duzunean.
Ziurtatu medikuarengana jo dezala aholkuetarako, zure gorputzaren ezaugarriak eta osasun orokorra kontuan hartuta. Sendagai hori (produktua) mendekotasuna edo adikzioa al da? Droga gehienak ez dira menpekotasuna edo adikzioa.
Gehienetan, estatuak mendekotasuna izan dezakeen drogak kontrolatzen ditu askatutako drogatzat. Adibidez, H edo X grafikoa Indian eta II-V grafikoa AEBetan. Irakurri botikaren paketearen inguruko informazioa, droga hori kontrolatuta ez dagoela ziurtatzeko.
Gainera, ez ezazu zeure burua medikatu eta ez ezazu ohitu gorputza sendagaietara medikua kontsultatu gabe. Posible al da berehala hartzeari uztea, edo dosia murriztu behar al dut? Zenbait botika pixkanaka eten behar dira berreskuratze efektua dela eta.
Ziurtatu medikua kontsultatzeko, aholkuak emateko zure gorputzaren ezaugarriak, osasun orokorra eta hartzen ari zaren beste botikak kontuan hartuta.
Hurrengo dosia galdu baduzu, hartu lehenbailehen. Hurrengo hitzordua gerturatzen bada, aurreko hitzordua saihestu eta zure ohiko botiken egitaraua jarraitzen jarraitu dezakezu. Ez hartu dosi gehigarririk galdutako dosia osatzeko.
Egoera hori aldian-aldian topatzen baduzu, kontuan hartu abisuak jartzea edo eskatu familiako kide bati ordutegiaren jarraipena egiteko.
Ziurtatu medikuarengana jo ezazu galdutako botikak konpentsatzeko ordutegia doitzeko (egun kopuru garrantzitsu bat galdu baduzu).
- Ez gainditu gomendatutako dosia. Droga gehiegi erabiltzeak ez du zure egoera arinduko, eta pozoitzeak eta bigarren mailako efektu larriak ere sor ditzake. Zaltrap injektagarriaren sobredosi bat ezagutzen baduzu, jarri harremanetan larrialdi zerbitzuekin, gertuen dagoen ospitalera edo ospitalera.
Ziurtatu ontzia, edukiontzia edo sendagaiaren izena eramatea diagnostikoa errazteko. Ez itzazu drogak beste pertsonei eman, nahiz eta zu bezalako egoera berdinean egon, edo zure baldintzek antzeko sintomak dituztela iruditzen zaizu, horrek gaindosia ekar dezake.
- Gorde prestaketak giro-tenperaturan, leku freskoan eta eguzki-argiaren kanpoan. Ez izoztu prestaketarik argibideetan berariaz hornitzen ez bada. Mantendu sendagaiak animalien eta haurrengandik urrun.
Ez itzazu prestakinak komuneko edo drainatze-sistemetara sartu argibideetan esplizituki adierazten ez badira. Horrela botatzen diren sendagaiek ingurumenean kalte handiak eragin ditzakete.
Zaltrap injektagarria botatzeari buruzko informazio gehiago eskuratzeko, jarri harremanetan zure osasun zerbitzuarekin.
- Zaltrap injektatutako dosi bakar batek ere ondorio larriak ekar ditzake. Ziurtatu zure medikuari kontsultatzea ahul edo mina sentitzen baduzu. Gainera, iraungitako droga batek eraginkortasuna galdu dezake zure gaixotasunaren aurkako borrokan.
Zure segurtasuna bermatzeko, oso garrantzitsua da iraungitako sendagaiak hartzeari uko egitea.
Sendagaiak etengabe eskatzen dituen gaixotasuna baduzu (bihotzeko gaixotasunak, konbultsioak, bizitza erreakzio alergikoak arriskuan jartzeko), zure droga hornitzailearekin komunikazio kanal fidagarria ezarri behar duzu bizitza iraunkorra duen sendagai freskoen stocka edukitzeko.
Mesedez, kontsultatu zure osasun arloko profesionalarekin edo farmazialariarekin, eta, gainera, begiratu produktuaren ontziei buruzko informazioa.
- Dailymed ETIKETA: ZALTRAP-ziv-aflibercept soluzioa, kontzentratua https://dailymed.nlm.nih.gov/dailymed/dr… - Saritua: 2016ko urriaren 12a.
- NHS Aukerak. Zer egin behar dut antibiotikoen dosi bat galduko banu? - Sarbidea: 2016ko uztailaren 14a.
- Inoiz galdu duzu medikuntzaren dosia? - Sarbidea: 2016ko uztailaren 3a.
- Cancer.Net (2014).
Sendagaiak behar bezala hartzearen garrantzia - Sarbidea: 2016ko uztailaren 3a.
Drogak iraungitze datak - Zerbait esan nahi al dute? - Sarbidea: 2016ko maiatzaren 1a.
Chicago estiloaren aipamena
- "Zaltrap injektagarriak - Erabilerak, bigarren mailako efektuak, Iritziak, osaera, elkarrekintzak, neurriak, ordezkoak eta dosifikazioa - Sanofi Aventis Us - TabletWise - AEB" Tabletwise. 2018ko urriaren 02an sartu zen. Https://www.tabletwise.com/us-ru/zaltrap-injectable.
Orrialde honek informazioa eskaintzen du Zaltrap Errusieraz injektagarria.